Diversité des héparanes sulfates et réponse inflammatoire
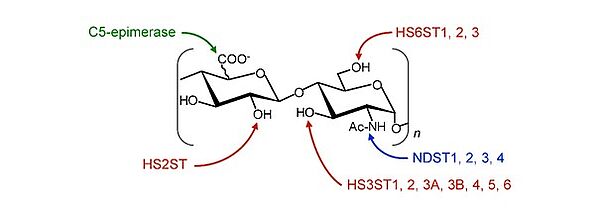
Les glycosaminoglycanes sont des polysaccharides sulfatés retrouvés en abondance à la surface des cellules et dans les matrices extracellulaires. Ils sont synthétisés sous la forme de polymères non sulfatés, dont l’unité de base est un disaccharide formé d’un acide glucuronique ou d’un galactose lié à une osamine, glucosamine ou galactosamine. Ces polymères subissent ensuite les actions coordonnées et séquentielles de plusieurs sulfotransférases sur des positions spécifiques des unités disaccharidiques. Au sein de cette famille, les héparanes sulfates (HS) sont les membres présentant la plus grande diversité structurale et fonctionnelle. La maturation du précurseur [GlcUA-GlcNAc]n fait intervenir une GlcUA/IdoUA épimérase et 15 sulfotransférases, qui peuvent sulfater les GlcN sur les groupements amines et hydroxyles en C3 et/ou C6, et les acides uronique en C2. Une fois synthétisés, les HS peuvent subir une dernière modification structurale, catalysée par des 6-O-endosulfatases sécrétées, les Sulfs. La majorité des enzymes de modification des HS sont représentées par plusieurs isoenzymes, qui possèdent des différences subtiles de spécificité de substrat. De plus, l’ensemble des modifications n’ayant pas lieu uniformément sur la même chaîne, il en résulte une organisation hétérogène, où des domaines fortement sulfatés alternent avec des domaines peu modifiés. La diversité structurale des HS influence directement les fonctions de leurs nombreux partenaires protéiques, incluant des facteurs de croissance, des cytokines, des protéases, des récepteurs membranaires ou des constituants de la matrice extracellulaire. Ainsi, les interactions avec les HS modulent la biodisponibilité de nombreux médiateurs cellulaires, influencent les mécanismes d’adhérence et de migration cellulaires et favorisent la formation de complexes de signalisation.
De nombreuses études ont mis en exergue l’implication des HS dans la régulation de nombreux processus physiopathologiques. En outre, la structure des HS, et donc leur propriétés d’interaction, est très variable en fonction du type cellulaire et peut être profondément remodelée en réponse aux modifications de l’environnement tissulaire. Toutefois, les mécanismes qui régulent l’expression et l’activité des enzymes de maturation des HS restent peu connus. Dans ce contexte, les travaux de l’Equipe portent sur les mécanismes de régulation des enzymes de modification des HS et sur l’impact du remodelage structural de ces molécules dans différents modèles de réponses inflammatoires normales et pathologiques. En particulier, nous focalisons actuellement nos travaux sur le rôle de la 3-O-sulfatation des HS dans la communication entre les cellules cancéreuses et le système immunitaire, et sur les conséquences de l’action des Sulf dans les processus neurodégénératifs. Ces travaux devraient montrer l’importance de ces enzymes de modifications des HS en tant que cibles dans le développement de nouvelles approches thérapeutiques.