Régulation des mécanismes moléculaires et cellulaires par la O-GlcNAcylation
L'équipe "Régulation des mécanismes moléculaires et cellulaires par la O-GlcNAcylation" concentre ses activités de recherche sur les fonctions biologiques jouées par la modification sensible aux nutriments qu'est la O-GlcNAcylation.
Etat de l'art
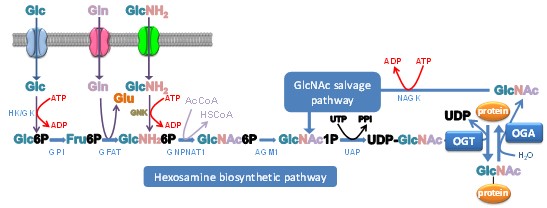
La O-GlcNAcylation est une modification post-traductionnelle (PTM) appartenant au grand groupe des glycosylations. Contrairement aux N-, O- et C-glycosylations, la O-GlcNAcylation des protéines est confinée dans les compartiments cytosolique, nucléaire et mitochondrial. La O-GlcNAcylation est très dynamique, tout comme la phosphorylation, avec laquelle elle peut soit agir de concert, soit entrer en compétition pour le même résidu sérine/thréonine ou les résidus adjacents. De plus en plus de preuves montrent qu'il existe également une diaphonie avec d'autres PTM (par exemple, l'acétylation, la méthylation, l'ubiquitination, la protéolyse...). Ces interactions offrent des combinaisons théoriquement infinies de PTMs sur les isoformes de protéines dans les protéomes. La diversité des protéines O-GlcNAcylées, la dynamique de la O-GlcNAcylation et son interaction avec d'autres PTMs font de cette glycosylation un régulateur de la plupart, sinon de tous les processus cellulaires de base et fondamentaux tels que la signalisation cellulaire, le cycle cellulaire et l'apoptose ; plus précisément, au niveau moléculaire, la O-GlcNAcylation interfère avec la transcription, la synthèse des protéines, la dégradation protéasomale et l'organisation du cytosquelette. L'addition et l'élimination du résidu GlcNAc sont médiées par la O-GlcNAc transférase (OGT), qui utilise le capteur de nutriments UDP-GlcNAc comme donneur de sucre, et la O-GlcNAcase (OGA) respectivement. Le niveau d'UDP-GlcNAc, fourni par la voie de biosynthèse de l'hexosamine (HBP), est étroitement corrélé à l'état nutritif de la cellule puisque de nombreuses voies métaboliques sont nécessaires à la biosynthèse du nucléotide-sucre (Fig. 1). En conséquence, en raison de sa position cruciale, il a été suggéré que la O-GlcNAcylation régule le métabolisme cellulaire et fonctionne de manière dépendante des nutriments.
Projets en cours
O-GlcNAcylation et cancer colorectal
Ce projet est consacré au rôle de la fonction des désordres métaboliques et nutritionnels dans l'émergence du cancer colorectal (CCR) de la O-GlcNAcylation. Le CRC est l'une des principales causes de mortalité et de morbidité par cancer et est souvent associé à des troubles métaboliques (obésité, diabète...). Largement répandus dans les sociétés occidentales, ces deux groupes de pathologies sont étroitement liés. Des travaux antérieurs réalisés par notre équipe ont montré que la O-GlcNAcylation est augmentée dans les lignées cellulaires et les tissus du cancer du côlon et modifie des protéines clés impliquées dans les processus cancéreux.
Résistance à la chimiothérapie
Certaines de nos études concernent la résistance aux médicaments des cellules tumorales qui reste un défi majeur pour l'efficacité des traitements curatifs. Plusieurs études épidémiologiques ont établi un lien entre les glycosylations altérées et les mécanismes de résistance aux médicaments du cancer colorectal de différentes manières : diminution de l'absorption et du métabolisme des médicaments, acquisition de la souche ou résistance à l'apoptose. Notre équipe s'est récemment concentrée sur la résistance au 5-FU, un médicament de chimiothérapie bien établi et utilisé en combinaison avec d'autres molécules, et étudiera ensuite la résistance au FOLFOX induite par une augmentation de la O-GlcNAcylation.
Développement d'un outil de diagnostic du CCR
Les tests actuels de dépistage du CCR manquent de fiabilité et donnent des faux-positifs dans 9 cas sur 10. Les vésicules extracellulaires (VEs) sont présentes dans certains fluides biologiques (sang, urine, selles...) et sont impliquées dans de multiples processus physiologiques et pathologiques comme le CRC. Nos données récentes montrent que les cellules du CRC produisent des EVs, contiennent des protéines impliquées dans les voies biologiques de la O-GlcNAcylation et le niveau de O-GlcNAc est augmenté dans ces EVs du CRC. De plus, nous avons récemment développé et validé un protocole pour isoler les VE à partir d'échantillons de selles (chien et humain). L'analyse d'une première cohorte de patients positifs au détecteur d'OC a révélé une toute nouvelle signature qui pourrait être utilisée ultérieurement dans la détection du CRC. Nos données apportent de nouvelles informations dans le domaine de la glycosylation des VE et soulignent l'importance de la O-GlcNAcylation pour diagnostiquer potentiellement le CRC.
Contrôle de la glycosylation complexe et du trafic vésiculaire par la O-GlcNAcylation - accent sur les modèles de sialylation
Dans la droite ligne des travaux précédents qui cherchaient à comprendre la relation entre les glycosylations complexes (N- et O-Glycanes, glycolipides) et la O-GlcNAcylation, une partie de nos activités a montré que la réduction de l'activité OGT modifie la glycosylation de LAMP2 et TGN46, respectivement marqueurs du lysosome et de l'appareil de Golgi. Ainsi l'idée selon laquelle la O-GlcNAcylation affecte les glycosylations complexes pourrait trouver une partie de sa réponse dans le contrôle du trafic vésiculaire et de la dynamique des microtubules. Ces analyses devraient permettre d'établir également un lien avec le flux autophagique. Dans cette même thématique, en collaboration avec l'équipe " Glycobiologie chimique " dirigée par le Pr. Christophe Biot (spécialiste en chimie bioorthogonale), nous travaillons à décrypter comment les patrons de sialylation peuvent être modifiés par la dynamique de la O-GlcNAcylation.
Le FASN O-GlcNAcylaté comme moteur putatif de la carcinogenèse
FASN (Fatty acid synthase) est impliqué dans une grande variété de processus biologiques, y compris la prolifération cellulaire, et est plus fortement exprimé dans les cellules tumorales. Nous avons récemment démontré que FASN interagit avec OGT et est donc O-GlcNAcylée. Nous avons également cartographié plusieurs sites putatifs de O-GlcNAcylation sur l'enzyme lipogénique, mais leur rôle individuel reste inconnu. Les mutants FASN à O-GlcNAcylation potentielle ont été générés afin de valider, ou d'invalider, ces différents sites. Maintenant, le niveau d'expression, la distribution subcellulaire, l'activité enzymatique de chaque mutant seront évalués, et l'interactome de chaque mutant sera exploré. Des xénographies chez des souris immonodéficientes seront entreprises pour évaluer le potentiel oncogène de FASN sous sa forme O-GlcNAcylée.
Suivi des protéines O-GlcNAcylées dans les cellules vivantes
En collaboration avec le Pr. Christophe Biot (groupe "Glycobiologie chimique") et le Dr. Corentin Spriet, de la plateforme PLBS, notre objectif est de disséquer le rôle de la O-GlcNAcylation sur la proto-oncoprotéine -caténine. Ce projet basé sur l'expansion du code génétique par l'incorporation d'acides aminés non naturels (UAA) combine la biologie moléculaire, la biologie chimique et l'imagerie ex vivo pour visualiser spécifiquement les isoformes O-GlcNAc/phospho de la -caténine dans les cellules vivantes. Nous avons précédemment combiné la stratégie du rapporteur chimique avec des protéines marquées par fluorescence (protéines GFP) ; bien que cette stratégie permette de suivre les formes O-GlcNAcylées de la -caténine dans les cellules, elle manque de flexibilité et ne permet pas de suivre un résidu O-GlcNAc spécifique de la protéine dans les cellules vivantes. Par conséquent, nous proposons maintenant d'exploiter l'incorporation d'UAA, une telle approche devrait être transposable à tout type de PTM dans toute protéine.
Investigation de la O-GlcNAcylation dans les processus de transcription
La protéine de liaison TATA-Box (TBP) est une plateforme universellement conservée pour l'assemblage des PIC (complexes de pré-initiation), TBP étant un acteur clé de la régulation dynamique de l'initiation de la transcription. Nous avons précédemment montré que TBP est dynamiquement modifié par O-GlcNAcylation à T114, T126 et S158. La O-GlcNAcylation spécifique de TBP à T114 est impliquée dans la formation du complexe B-TFIID, d'où l'association dynamique de TBP à la chromatine et la redistribution du promoteur TBP. La glycosylation de TBP à T114 régule un ensemble de gènes impliqués dans le métabolisme des lipides. Pourtant, les rôles primaires de la O-GlcNAcylation de T126 et S158 restent inconnus. Néanmoins, la O-GlcNAcylation spécifique du TBP peut avoir un impact profond sur le transcriptome et la physiologie des cellules. Nous proposons de documenter la fonction spécifique de ces résidus, en utilisant des approches combinées de transcriptomique et de protéomique sur des lignées cellulaires modifiées par CRISPR, ainsi que des études de conformation de structure et d'activité de flexion de l'ADN. Les phénotypes des lignées cellulaires modifiées par CRISPR seront étudiés plus en détail afin de relier le rôle de chaque site de O-GlcNAcylation de la TBP sur la physiologie cellulaire au mécanisme moléculaire sous-jacent.