Mécanismes moléculaires de la N-glycosylation et maladies associées
Notre équipe s’intéresse aux mécanismes de régulation fine des différentes étapes de la glycosylation, dans le réticulum endoplasmique (RE) et le Golgi, concernant plus particulièrement le trafic vésiculaire et l’homéostasie ionique via l’étude de glycopathologies humaines.
Le large spectre de glycanes portés par les glycoconjugués (glycoprotéines, protéoglycanes et glycolipides) contribue à la diversité et l’adaptabilité des cellules, tant dans leurs fonctions que dans leurs capacités d’interactions. Cette hétérogénéité glycanique est générée presqu’exclusivement au sein de la voie de sécrétion, le RE et l’appareil de Golgi, par l’action d’une batterie de glycosidases et de glycosyltransférases spécifiques. Tout dysfonctionnement dans la synthèse de ces structures est à l’origine de maladies génétiques et métaboliques rares regroupées pour la plupart sous le terme de « Désordres Congénitaux de la Glycosylation » (CDG) affectant de multiples organes et presque toujours le cerveau. L’originalité de notre travail fut de considérer que les défauts génétiques retrouvés dans les CDG n’affectaient pas seulement les enzymes impliquées dans la maturation des glycanes, mais également certains acteurs moléculaires régulant leurs activités.
Nos recherches sont à la fois de nature translationnelle, visant à identifier et caractériser des cas non résolus de CDG et rechercher des thérapies pour ces patients, et de nature fondamentale pour la caractérisation et l’étude de la fonction des différents acteurs moléculaires identifiés et impliqués dans les mécanismes de régulation. Nos travaux sont à l’origine de pistes thérapeutiques à base de manganèse et galactose pour le traitement de certains patients CDG.
Notre équipe possède de nombreuses collaborations nationales et internationales sur les thèmes développés ci-dessous. Nous avons également un partenariat étroit avec l’équipe du Pr. G Matthijs (KU Leven) avec laquelle nous avons obtenu le label « Laboratoire International Associé » (LIA CNRS/FWO).
Pour répondre à nos questions, nous utilisons dans tous nos travaux des approches biochimiques et moléculaires, de l'imagerie sophistiquée ainsi que de l’analyse structurale (spectrométrie de masse/ marquages métaboliques radioactifs). Ces différentes méthodes sont appliquées sur l’ensemble des différents modèles cellulaires à notre disposition (cellules de patients, cellules isogéniques KO pour les gènes d’intérêt, cellules de levure).
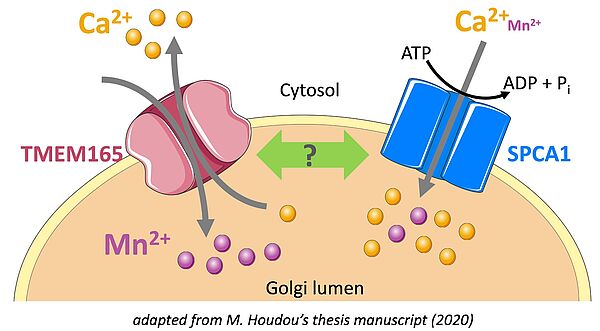
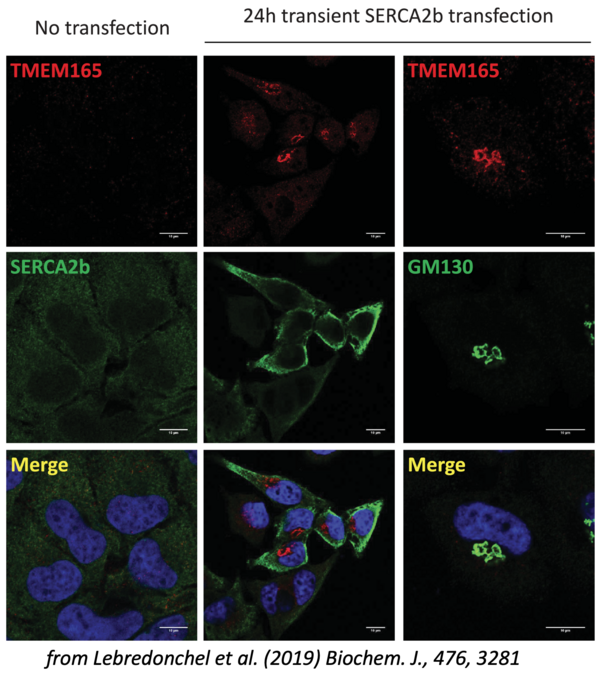
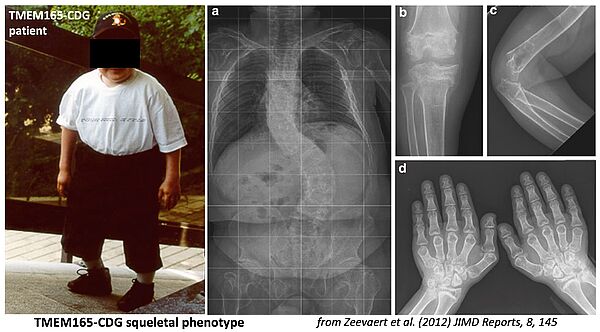
L’importance de l’homéostasie en Ca2+ et en Mn2+ dans les processus de glycosylation de la voie de sécrétion constitue le thème de recherche central de l’équipe. La caractérisation par l’équipe dès 2012 de patients CDG déficients dans la protéine TMEM165, atteints principalement de retard mental et de dysplasie squelettique, a ouvert un formidable champ d’investigation sur cette molécule qui s’avère être un transporteur membranaire clef de Mn2+ dans le Golgi où cet ion joue un rôle de cofacteur pour de nombreuses enzymes de glycosylation. De manière intéressante, nos résultats suggèrent que les homéostasies en Mn2+ et en Ca2+ dans le Golgi, régies principalement par TMEM165 et SPCA1, un transporteur fonctionnellement lié à TMEM165, jouent un rôle crucial dans les processus de glycosylation.
En lien avec ces études, l’équipe s’intéresse également au rôle de SLC10A7, découvert déficient chez des patients CDG présentant un phénotype de dysplasie squelettique très voisin de celui de TMEM165-CDG. En collaboration avec le Pr. Valérie Cormier Daire (Imagine, Paris), nous cherchons à comprendre la fonction de SLC10A7 dans la glycosylation.
Enfin, l’équipe s’intéresse à l’importance du métabolisme des oligosaccharides libres (fOS) libérés lors du processus de N-glycosylation des protéines, et plus particulièrement à celle liée à l’activité de la mannosidase cytosolique MAN2C1 chargée de leur catabolisme. De manière très intéressante, des patients déficients en MAN2C1 présentant des malformations cérébrales et une déficience intellectuelle ont été récemment caractérisés. Cette découverte ouvre un champ d’investigations important visant à comprendre le rôle des fOS et de la MAN2C1 dans le développement neuronal.