GLYCOSTRESS
Recherche
De nombreuses observations épidémiologiques réalisées chez la femme enceinte ont montré l’existence d’une corrélation entre les stress subits pendant la gestation et les conséquences sur la descendance : fausses couches, naissances prématurées, faible poids corporel (Seckl, 2004). Ceci a conduit au développement du concept d’origine développementale de la santé et des maladies (Developmental Origini of Health and Diseases, DOHaD). Les recherches sur l’Homme étant difficiles à mettre en œuvre, nous disposons de modèles animaux permettant d’approfondir ce concept. Plus particulièrement, il s’agit d’étudier comment l’exposition à un environnement néfaste pendant la vie précoce peut programmer la prédisposition de la descendance à des pathologies susceptibles de survenir tout au long de la vie voire de se transmettre au cours des générations.
Le modèle de stress périnatal chez le rat, développé par le Pr Maccari en 1995, consiste à soumettre des rates gestantes à un stress de contention. Les animaux issus de mères stressées (PRS, Prenatal Restraint Stress) présenteront un phénotype de type anxieux/dépressif (Maccari et al.,1995) caractérisé par des :
- Dérèglements neuroendocrines, particulièrement au niveau de l’axe hypothalamo-hypophyso-surrénalien
- Altérations des rythmes circadiens
- Altérations du comportement
Nous avons aussi pu mettre en évidence un effet transgénérationnel du stress. En effet, la vulnérabilité au développement de pathologies liées au stress peut être programmée par l’intermédiaire du comportement maternel. De ce fait, nous avons mesuré le comportement maternel tant des mères directement exposées à des épisodes répétés de stress de contention au cours de la gestation (que nous appellerons ici « grand-mères ») que de leur descendance femelle (que nous appellerons « mères », une fois que ces dernières donneront une descendance). Chez les « grand-mères », le stress gestationnel diminue sensiblement les soins maternels. Dans la descendance mâle de ces « grand-mères », nous avons pu montrer que le stress périnatal de contention induit à long terme des modifications biochimiques et comportementales qui conduisent à l’expression d’un phénotype de type anxieux/dépressif. De façon intéressante, la plupart des altérations comportementales et neurobiologiques associées au stress prénatal de contention persistent à la seconde génération (ici dans la descendance des « mères »), malgré le fait que ces rats mâles n’étaient soumis à aucun stress in utero. De plus, le comportement maternel de leur mère (descendance femelle des « grand-mères » stressées) n’est que légèrement affecté alors que ces rats ne montrent plus de profil de type anxieux.
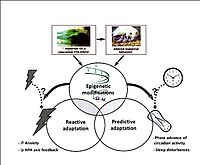
Les mécanismes à travers lesquels ces expériences néfastes sont transmises de génération en génération ne sont pas encore clairs et ne peuvent s’expliquer uniquement par des altérations de comportement maternel. Ainsi, d’autres mécanismes peuvent être activement impliqués. En effet, dans le système nerveux central, le stress périnatal induit des modifications d’ordre épigénétique, c’est à dire liées à des changements transmissibles de l’expression des gènes sans pour autant affecter la séquence de l’ADN (voir figure 1). Ces processus épigénétiques sont potentiellement réversibles, montrant que nos données peuvent ouvrir de nouvelles perspectives pour la recherche en psychiatrie et donner ainsi une nouvelle approche à la définition obsolète d’irréversibilité des désordres psychiatriques.
Le travail que nous menons au sein de l’Unité de Glycobiologie Structurale et Fonctionnelle s’articule autour des axes de recherche suivants
1) Programmation épigénétique des synapses glutamatergiques de l’hippocampe ventral corrélé à un phénotype de type anxieux/dépressif chez les rats PRS
2) Programmation épigénétique du système dopaminergique des rats PRS : rôle dans l’apparition de troubles extrapyramidaux au cours du vieillissement
3) Implication du système ocytocinergique et dopaminergique dans les effets programmateurs du stress périnatal d’un phénotype anxieux/dépressif ainsi que d’une vulnérabilité à la drogue chez les rats PRS
Membres
Pr Stefania Maccari, Pr Sara Morley Fletcher, Dr Hammou Bouwalerh, Dr Gilles Van Camp